Registra Chile sismo 7.6 y activa precaución en zona antártica
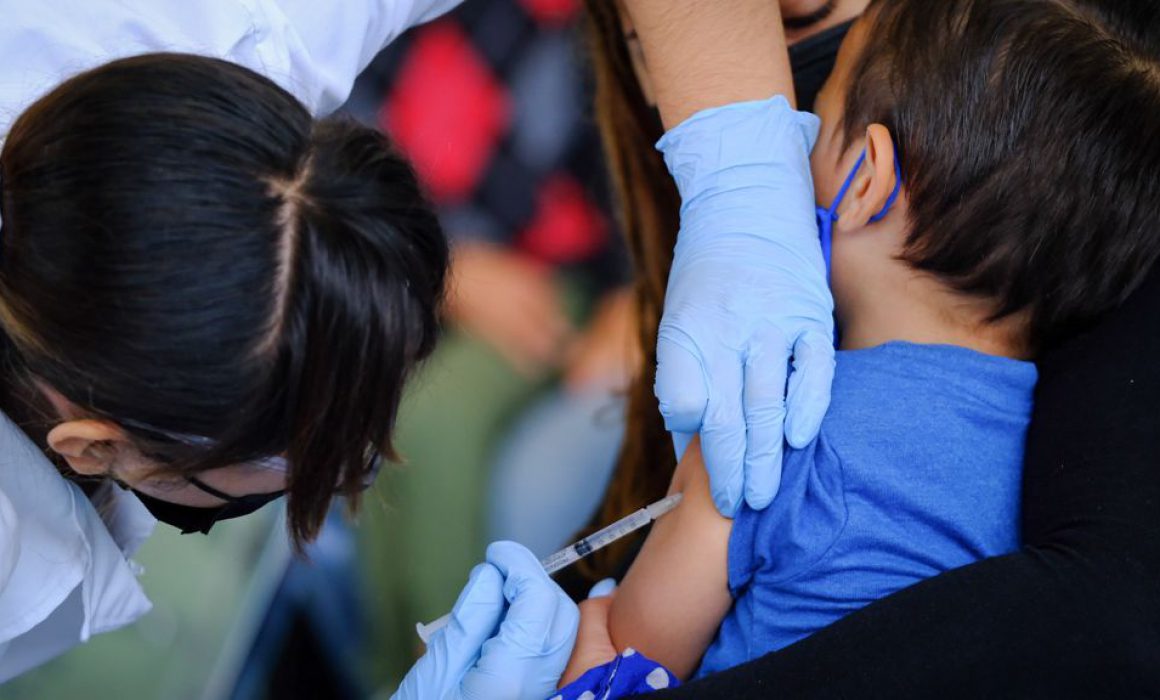
GUADALAJARA, Jal., 17 de junio de 2022.- El proceso de vacunación contra Covid 19 continúa avanzando y es que este viernes al Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) autorizó el uso de emergencia de las dosis en niños a partir de 6 meses de edad.
Por medio de un comunicado de prensa la FDA dio a conocer que las farmacéuticas Moderna y Pfizer-BioNTech son las autorizadas para dicho proceso.
Para la dosis de Moderna, la FDA modificó la autorización de uso de emergencia para incluir la aplicación de esta vacuna en personas de 6 meses a 17 años de edad. La vacuna ya había sido autorizada para su uso en adultos mayores de 18 años.
Para Pfizer-BioNTech, la Administración modificó la Estados Unidos para incluir la aplicación de esta vacuna en personas de 6 meses a 4 años de edad. La vacuna ya había sido autorizada para su uso en personas de 5 años o mayores que es la que se estará aplicando en los próximos meses a menores mexicanos.
Señalan en el comunicado que para tranquilidad de los padres de familia, antes de tomar la decisión de autorizar estas vacunas para las respectivas poblaciones pediátricas, se consultó al Comité Asesor de Vacunas y Productos Biológicos Relacionados de la FDA, el cual, como órgano independiente, votó a favor de las autorizaciones.
“Muchos padres, cuidadores y proveedores de atención médica han estado esperando una vacuna para los niños más pequeños, y esta medida ayudará a proteger a los niños a partir de los seis meses de edad. Al igual que con los grupos de mayor edad, esperamos que las vacunas para los niños más pequeños ofrezcan protección contra los casos graves del Covid 19, como la hospitalización y la muerte”, sostuvo el comisionado de la FDA, el Dr. Robert M. Califf, M.D. “Aquellos a quienes se les confía el cuidado de los niños pueden tener la tranquilidad de que la FDA evaluó exhaustivamente los datos disponibles para garantizar la seguridad y eficacia de estas vacunas contra el Covid 19”.
Detalló la FDA que Moderna se administra como un esquema principal de vacunación de dos dosis, con un mes de diferencia entre las dosis, a personas de seis meses a 17 años de edad. También está autorizada la administración de una tercera dosis del esquema principal de vacunación, al menos un mes después de la segunda dosis, en personas en este grupo de edad que presenten ciertos tipos de inmunodepresión.
Mientras que Pfizer-BioNTech se administra como un esquema principal de tres dosis, en la cual las dos iniciales se colocan con tres semanas de diferencia, seguidas de una tercera dosis puesta al menos 8 semanas después de la segunda dosis en personas de 6 meses a 4 años de edad.
“Al igual que con todas las vacunas para cualquier población, al autorizar las vacunas contra el Covid 19 destinadas a grupos de edad pediátrica, la FDA se asegura de que nuestra evaluación y análisis de los datos sean rigurosos y exhaustivos”, afirmó el Dr. Peter Marks, director del Centro de Evaluación e Investigación de Productos Biológicos de la FDA. “Además de asegurarnos de que los datos de estas vacunas cumplían con los rigurosos estándares de la FDA, la convocatoria por parte de la agencia de un comité asesor formó parte de un proceso de transparencia que permite al público tener una comprensión clara de los datos de seguridad y eficacia que respaldan la autorización de estas dos vacunas para la población pediátrica”.